De l’analyse des groupes sanguins à la sélection des résistances
Peter Vögeli – un pionnier de la génétique porcine
Les organisations d’éleveurs de porcs ont reconnu très tôt l’importance des méthodes de laboratoire (biochimie et plus tard génétique moléculaire) pour l’élevage pratique des porcs. En 1980, un accord sur la création et le maintien d’un centre de services scientifiques pour la détermination du groupe sanguin et du type d’enzyme chez les porcs est entré en vigueur entre l’EPF Zurich et les organisations d’élevage de porcs. Peter Vögeli prend la tête du laboratoire et joue un rôle décisif dans son évolution pendant 32 ans, jusqu’à sa retraite.
Au cours des premières années, le laboratoire a développé les bases de la détermination des groupes sanguins, des protéines et des enzymes. Il y avait 15 loci génétiques de type sanguin, 15 de type protéique et 10 de type enzymatique disponibles pour les contrôles de lignée. Par la suite, les relations entre ces groupes sanguins et les caractéristiques de performance ont été étudiées.

Susceptibilité au stress
Pour les travaux pratiques d’élevage, la relation entre certains groupes sanguins et la sensibilité au stress était pertinente. En complément du test à l’halothane, qui ne permet de détecter que les animaux homozygotes sensibles au stress, les animaux porteurs hétérozygotes ont également pu être identifiés grâce à l’haplotypage.
Maladies héréditaires
En laboratoire, on a par exemple étudié la carence en vitamine C (héritée de façon récessive, les animaux atteints ne peuvent pas produire de vitamine C et sont dépendants d’un supplément dans l’alimentation) ou l’ataxie progressive congénitale (APC : trouble neuropathogène hérité de façon récessive, qui entraîne un retard de croissance et finalement la mort). L’Arthrogryposis Multiplex Congenita (AMC) est un autre exemple de maladie héréditaire récessive étudiée en laboratoire. Grâce à la collaboration de l’unité de génétique animale avec le groupe de génomique animale, 25 ans plus tard, le site du gène responsable de l’AMC a été identifié à l’aide de méthodes de génétique moléculaire.

Résistance à E. coli F18
Ce type de coli est principalement responsable de la maladie des œdèmes et de la diarrhée de sevrage en Suisse. Le laboratoire a développé un test de génétique moléculaire qui est utilisé avec succès dans l’élevage depuis 1996. En 1997, l’EPF Zurich a déposé la demande de brevet correspondante. Entre-temps, tous les Grand Porcs Blancs suisses sont résistants.
Résistance à E. coli F4
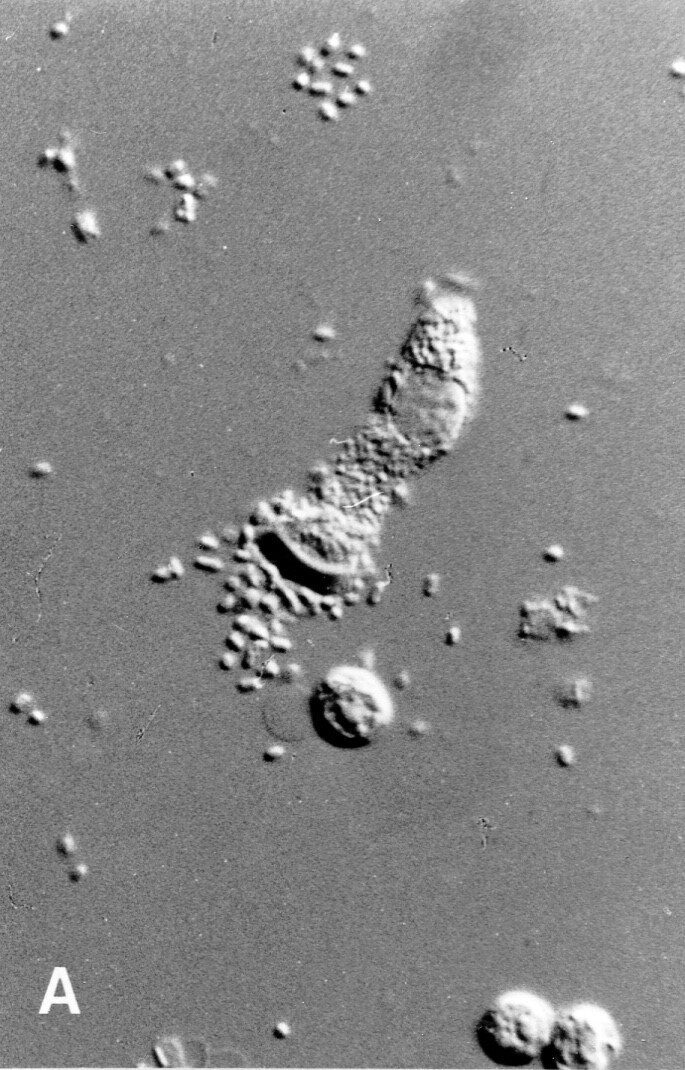
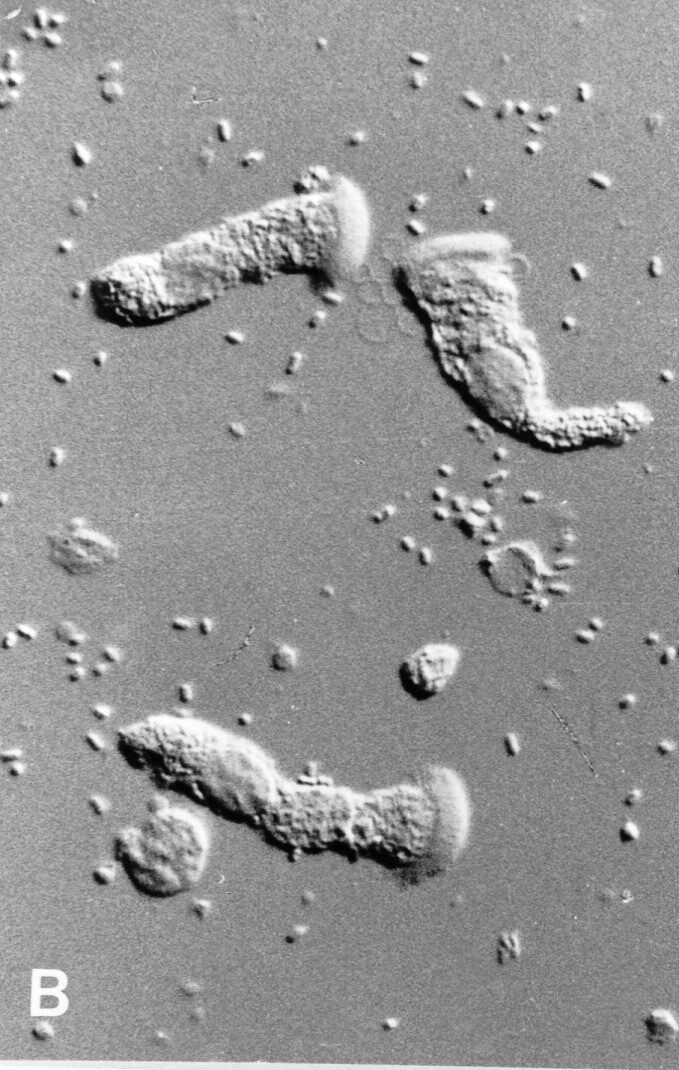
Une grande partie des diarrhées néonatales et de sevrage est due à des infections par des souches d’E. coli qui possèdent des fimbriae F4. Le locus du gène du site d’adhésion (récepteur) de la bactérie dans l’intestin grêle n’a pas encore été identifié. Si le porc est réceptif, on peut observer une fixation des bactéries à la bordure en brosse de la cellule intestinale ; sans récepteur, cela n’est pas possible. Ce n’est que récemment, cependant, que l’actuelle unité de génétique animale dirigée par Stefan Neuenschwander a trouvé des marqueurs étroitement liés au gène récepteur. Ces marqueurs améliorent considérablement l’identification correcte des porcs résistants.
Les éleveurs, en Suisse et ailleurs, ont commencé, en utilisant la sélection assistée par marqueurs, à augmenter la fréquence des allèles de résistance, réduisant ainsi l’incidence de la maladie dans leurs troupeaux et l’utilisation d’antibiotiques, ce qui est également bénéfique pour le bien-être des animaux.